과연 우리나라 자외선차단제를 미국에 판매할 수 있을까? ‘미국 판매 호조’ 소식이 들리지만 미국 화장품규제 현대화법(MoCRA) 시행에 따라 수출기업들 사이에선 불안감을 감추지 못하고 있다.
그 이유로 ▲ 자외선차단제에 대한 국가별 차이 ▲ 제조사의 리스크 ▲ 신제품 차별화 어려움 등이 꼽힌다.
지난 7월 2일 대한화장품협회 주최 ‘미국 OTC Sunscreen Monograph' 웨비나에는 280여 명이 접속, 사전+실시간 40여 개 질의가 쏟아졌다. 기업들은 FDA의 OTC 관리와 제조사 실사, 라벨 표기 관련 고민과 불안을 털어놓았다. 강의를 맡은 칼 뒤르즈(Carl D'Ruiz)는 PCPC(미국화장품협회)의 자외선차단제 컨소시엄 DSM-Firmenich의 수석과학자다.

웨비나의 대표 질문은,
➊ OTC 등록 진행 비용이 품목 당 5천만원이 소요되는데 제품에 따라 다른 것인지 아니면 비용이 모두 동일한 건지?
➋ 미국 수출시 선크림 성분 포함 OTC 등록이 법적 필수사항인지, 인증이 없을 시 아예 수출이 불가능한지? 또 아마존 판매 제품은 어떻게 되는지?
➌ 미국 소비자의 역직구 구매는 OTC 미등록, 한국 주성분 기준으로 개발된 제품인데 미국 통관 또는 판매 중 거부/판매 중지 사례가 있는지? 역직구 사실을 인지하지 못했던 그 제품의 제조시설에도 패널티가 부과되는지?
➍ 선제품을 일반 의약품 아닌 화장품으로 제품 판매 시 불이익은? 또 유기자차 성분을 포함하고 선스크린 효능·효과(SPF, Sunblock) 등을 제품 라벨이나 상세페이지 어느 곳에도 클레임 하지 않고 일반화장품 판매 가능한지?
➎ 쿠션팩트의 OTC 등록을 위해서 테스트가 진행되어야 한다면 컬러별로 모두 OTC 테스트를 거쳐야 하는지, 제품 하나만 받아도 되는지? 등으로 모아진다.
MoCRA 실제 대응을 앞둔 브랜드사들의 고민이자 OEM/ODM사들이 민감해하는 내용들이어서 ‘준비된’ 대응이 요구된다. 왜냐하면 일개 기업으로 끝날 문제가 아닌 전체 한국산 화장품에 대한 신뢰 훼손 또는 시장 퇴출 등을 불러올 수 있는 사안이기 때문이다.
먼저 자외선차단제를 미국에 보낼 때는 OTC 등록을 반드시 받아야 하며, 라벨 표기에 주의를 기울여야 한다. 글로벌 시장에서 자외선차단제는 ▲ 화장품: EU 뉴질랜드 중국 일본 인도 ▲ 기능성화장품: 한국 ▲ 비처방 의약품(OTC): 미국 캐나다 등으로 분류한다.
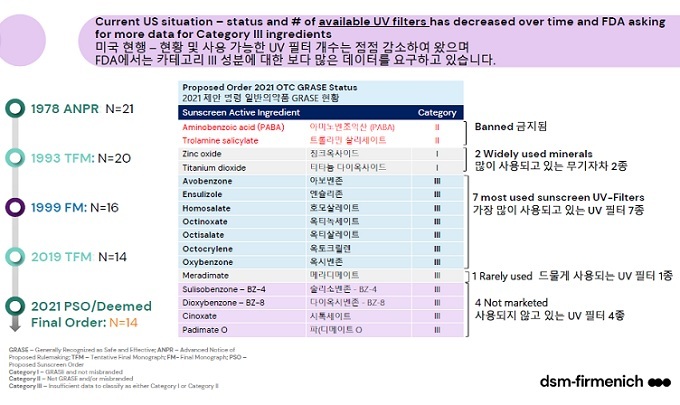
국내에서 허가받은 차단제 성분은 31종이지만 미국 FDA는 16종만 인정한다. 1999년 이후에 추가된 성분은 없다. 활성성분은 △ 그라스(GRASE: 징크 옥사이드 및 티타늄 다이옥사이드) 2종, △ Non GRASE-카테고리 Ⅱ(2종), △ 카테고리Ⅲ(12종)-추가 데이터 요구 등으로 구분한다. 라벨에 기재할 수 있는 최대 SPF지수는 60+까지 표기가 가능하다. 칼 뒤르즈 박사에 따르면 실제 사용 중인 성분은 9종에 불과하다.
FDA화장품인증원 정연광 대표는 “라벨에 SPF, PA 수치가 표시된 건 전부 선스크린 제품이다. OTC 등록이 필수다. 선크림 활성성분 16종 외 성분이 들어있다면 신약(의약품) 허가(OMOR)를 받아야 한다”라고 말했다. 또한 “제품 리스팅을 하게 되면 Cosmetic Product Listing Number 52-838316-070587처럼 14자리 번호가 부여된다. 미국 아마존 밴더들이 리스팅 넘버를 요구하는 것으로 알고 있다”라고 전했다.

첫째 질문의 경우 FDA는 ‘OTC 모노그래프 의약품 사용자 비용 프로그램’(OMUFA)에 의해 ‘OTC 제조자’에게 수수료를 부과 및 징수한다. ‘24년 책정 수수료는 $34,166(약 4800만원)이다. 일반 화장품은 $22,777(약 3200만원)이다.
그런데 기자가 복수의 브랜드에 문의한 결과 제조사마다 품목 당 3~5천만원을 요구하는 것으로 나타났다. OMUFA 비용을 전가한다고 해도 개별 품목에 거액을 요구하는 것은 제조사의 횡포라고 할 수밖에 없다. 칼 뒤르즈 박사도 이 질문에 대해선 왜 5천만원인지는 이해하지 못했다.
둘째 질문은 OTC 미등록 선크림의 아마존 판매 불가능한가?였다. 칼 뒤르즈 박사는 “전자상거래 플랫폼은 유통사라서 FDA가 직접 규제를 가하기보다, 플랫폼사의 자체 모니터링 또는 FDA 규정에 벗어나지 않기 위해 자체 기준을 세우도록 하고 있다. 아마존도 그렇게 하고 있을 것”이라고 답했다.
셋째, OTC Drug 등록을 하지 않은 제품 또는 신약 허가(NDA)를 받지 않은 의약품(미국 자외선차단제 성분이 아닌 경우)이 세관에서 발견될 경우, 세관은 FDA에 통보하며, FDA는 해당 제품을 억류, 압수, 재반출, 폐기 조치를 취할 수 있다. 또 미국 법규 미준수시에는 FDA가 제조사 실사(inspection)을 하지 않더라도 먼저 경고서한(Warning Letter)을 FDA 웹사이트에 게재하여 해당 업체에 경고한다. 칼 뒤르즈 박사는 “미국 FDA 경고서한의 대표적인 유형은 ‘화장품으로 판매한 제품에서 의약품의 효능·효과를 클레임’(표시광고) 한 경우”라고 강조했다.
넷째 OTC 의약품의 경우 FDA에 등록(Drug Listing)을 해야 한다. 화장품도 MoCRA에 따라 FDA에 제품 리스팅을 해야 한다. 즉, FDA는 제품 정보를 시스템상에서 관리하고, 제품에 문제가 발생할 경우 이를 추적하여 조치를 취하려는 것이다. 칼 뒤르즈 박사는 “‘규정 준수를 해야 하나, 안해도 되는 것 아닌가‘라고 생각하면 안된다. 앞 질문처럼 경고서한, 수입경보(Import Alert)를 받게 되면 수출 자체가 불가능해진다. 매번 FDA에 규정 준수 여부를 증명해야 하기 때문에 제품 유통 지연, 납기 미준수 등 불이익을 받는다”라고 설명했다.
다섯째, FDA는 마스터 제형이 아닌 각 개별 제형에 대해 SPF 테스트를 요구하고 있다. 이는 제형에 사소할지언정 어떠한 종류라도 변형이 있다면 별도의 SPF 테스트가 필요하다는 것을 의미한다. 칼 뒤르즈 박사는 “각 제품의 특정 제형의 SPF 값을 확인하고 안전성과 유효성에 대한 요구 사항을 충족하기 위해 개별 제품별로 테스트되어야 한다”라고 덧붙였다.
이 조항과 관련해서 지난 3월 식약처가 ‘자외선차단제 기능성 심사 가이드’ 개정 의견 수렴을 한 바 있다. 우리나라 자외선차단제가 글로벌 시장에서 인기리에 판매되고 있는 만큼 심사도 글로벌 스탠다드에 맞게 엄격해질 것으로 보인다. 현재의 기능성 심사 ‘보고’를 대폭 축소할 것으로 관측된다. 이렇게 되면 품목마다 새롭게 임상비용 증가가 예상된다. 다만 내용을 보면 미국은 무기자차만 인정하고 있음을 알 수 있다. 이는 피부암, 흑색종 발생과 관계가 있다. 기업들은 레시피에 따른 임상자료만 확보하고 있으면 이에 대해 FDA가 소비자 문제만 발생하지 않는다면 제재하지 않는다는 점을 고려하면 된다.

게다가 지금은 ‘다기능 자외선차단제 시대’다. △ 유/무기 배합으로 자외선 A와 B 동시 흡수 차단 △ 언더 메이크업으로 색조 화장의 밀착성과 지속성을 높이는 메이크업 베이스로 원형 파우더에 의해 빛이 산란 △ 펩타이드 성분의 자외선 자극에 대해 피부 보호, 손상된 피부 복구, △ 히알루론산 함유로 지속적으로 수분 공급 등 기존 로션 대신에 메이크업 위에 수시로 덧바를 수 있는 제품 등이 다양하게 개발되고 있다. 또 트윈케이크 파우더, 스프레이, 스틱 형태 등 제형도 다양하게 선보이고 있다.
때문에 자외선 차단이 ‘기본 기능화’되고 있는 상황에서 효능·효과에 SPF, PA 지수를 표기할 경우 미국 진출 시 OTC 등록은 불가피하다. 게다가 제조사들이 OTC OMUFA 비용 및 공장 실사에 대한 부담감으로 5천만원의 별도 비용을 요구하고 있어, 한국산 자외선차단제의 미국 시장 진출은 벽에 부닥칠 수밖에 없다. 모 브랜드의 OTC 미등록 자외선차단제가 미국에서 인기리 판매된다는 소식에 외려 불안해하는 기업들이 많은 이유다. 차별화된 제품 개발도 난항이 예상된다.






























